Знаменитый учёный, химик Дмитрий Иванович Менделеев создал знаменитую "Периодическую систему химических элементов" по которой учатся в школе и многих факультетах. У меня "Периодическая система Д.И. Менделеева" станет этакой рубрикой. И эта рубрика будет рассказывать вам о знаменитой "Таблице Менделеева". Мы начнём со словарика. Каждый раз в рубрике я буду давать три слова. Кстати, нажимая на синее слова, вы можете узнать их понятие.

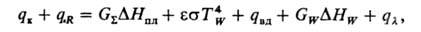
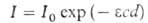
ВОДОРОДВОДОРОД (лат. Hydrogenium, от греч. hydor - вода и gennao - рождаю) Н, первый, наиб. легкий хим. элемент периодич. системы Менделеева, ат. м. 1,0794 + 0,0007 (второе слагаемое учитывает колебания изотопного состава). Прир. водород состоит из двух стабильных изотопов: протия 1Н и дейтерия 2Н, или D; содержание последнего (1,1-1,6)*10-3 ат. %; известен также радиоактивный изотоп -тритий 3Н, или Т. Ядро атома протия - протон. Атом водорода имеет одинэлектрон, занимающий 1s1-орбиталь; степень окисления + 1 (наиб. распространена), — 1 (в гидридах щелочных металлов). Энергия ионизации Н° -> Н+ 13,595 эВ; сродство к электрону 0,75 эВ; электроотрицательность по Полингу 2,1; ат. радиус 0,046 нм. Изотопы водорода образуют двухатомные молекулы: Н2, HEX D2, DT, НТ и Т2. Константа диссоциации Н2 2,56*10-34(300 К), 1,22*10-3 (2000 К); энергиядиссоциации Н2 436 кДж/моль; межъядерное расстояние 0,07414 нм; осн. частота колебаний атомов 4405,30 см -1, поправка на ангармоничность 125,32 см -1. Содержание водорода в земной коре (литосфере и гидросфере) 1% по массе, или 16 ат.%, в атмосфере -10-4 ат.%. В природе водород распространен чаще всего в виде соед. с О, С, S, N и С1, реже - с Р, I, Вr и др. элементами; он входит в состав всех растительных и животных организмов, нефти, ископаемых углей, прир. газа, воды, ряда минералов и пород (в форме гидратов). В своб. состоянии на Земле встречается очень редко (в небольших кол-вах - в вулканич. газах и продуктах разложения орг. остатков). Водород - самый распространенный элемент Вселенной; в виде плазмы он составляет ок. половины массы Солнца и большинства звезд, осн. часть газа межзвездной среды и газовых туманностей. Свойства. Водород - бесцв. газ без вкуса и запаха; плотность при 273,15 К и атм. давлении 0,0899 кг/м3 (0,0695 по отношению к воздуху); мольный объем 22,43 м3/кмоль. Коэф. сжимаемости (pv/RT)при 273,15 К : 1,0006 (0,1013 МПа), 1,0124 (2,0266 МПа), 1,0644 (10,133 МПа), 1,134 (20,266 МПа), 1,277 (40,532 МПа); С°р14,235 кДж/(кг*К), С? 10,090 кДж/(кг*К); ур-ние температурной зависимости Сp° в интервале 298-3000 К: С° = 4,1868(6,52 + 0,78*10-3 Т+ + 0,12*105/Т2) Дж/(моль*К);  Нoсгор-143,06 МДж/кг; температурный коэф. объемного расширения 3658,8*10-1 К-1 в интервале 273-373 К; Нoсгор-143,06 МДж/кг; температурный коэф. объемного расширения 3658,8*10-1 К-1 в интервале 273-373 К;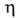 газа 0,88-10" 5 Па*с (293,15 К); показатель преломления газа п589,3 1,000132. газа 0,88-10" 5 Па*с (293,15 К); показатель преломления газа п589,3 1,000132.Водород быстрее др. газов распространяется в пространстве, проходит через мелкие поры, при высоких т-рах сравнительно легко проникает сквозь сталь и др. материалы. Обладает высокой теплопроводностью, равной при 273,15 К и 1013 гПа 0,1717 Вт/(м*К) (7,3 по отношению к воздуху); ур-ние температурной зависимоститеплопроводности: 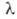 = 0,1591 (367/T + 94)(Т/273)3/2 Вт/(м*К). = 0,1591 (367/T + 94)(Т/273)3/2 Вт/(м*К).Р-римость водорода: в воде при 273,15 К и атм. давлении -0,0215% по объему; при 298,15 К и 10,133 МПа в воде - 1,73 см3/г, в метаноле - 11,0 см3/г. Водородхорошо раств. во мн. металлах, лучше всего в Pd (в одном объеме Pd раств. 850 объемов водорода). Губчатое железо при 0,1013 МПа и 973 К поглощает 0,14, а при 1173 К - 0,37 объемов водорода на 1 объем металла. Водород может находиться в орто- и пара-состояниях. Ортоводород (о-Н2) имеет параллельную (одного знака) ориентацию ядерных спинов, параводород (п-Н2) - антипараллельную. Это обусловливает нек-рое различие магнитных, оптич. и термич. св-в указанных модификаций. При обычных и высоких т-рах Н2(нормальный водород, н-Н2) представляет собой смесь 75% орто- и 25% пара-модификаций, к-рые могут взаимно превращаться друг в друга (орто-пара-превращение). Различают также равновесный водород (р-Н2), имеющий равновесный орто-пара-состав для данной т-ры (табл. 1). При превращ. о-Н2  п-Н2выделяется тепло (1418 Дж/моль). Такое превращ. характерно и для др. изотопов водорода. п-Н2выделяется тепло (1418 Дж/моль). Такое превращ. характерно и для др. изотопов водорода.Самопроизвольное орто-пара-превращение водорода при низкой т-ре происходит очень медленно, что позволяет получать жидкий водород, близкий по орто-пара-составу к н-Н2, хотя термодинамически устойчив при этих условиях только п-Н2. Орто-пара-превращение ускоряется в присут. катализаторов (активного угля, оксидов и гидроксидов ряда металлов, в т. ч. РЗЭ, и др.). Нек-рые св-ва модификаций водорода приведены в табл. 2, св-ва жидкого водорода- в табл. 3. Теплоемкость жидкого водорода мало зависит от орто-пара-состава; ур-ние температурной зависимости: С? = 6,86 + + 0,66*10-4 T + 0,279*10-6 Т2 кДж/(кг*К); ур-ние температурной зависимости теплопроводности жидкого водорода под давлением паров (независимо от орто-пара-состава): 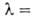 =1,16(1,70+ 0,0557Т)*10-4Вт/(м*К); показатель преломления n435,9 1,1118 при 20,33 К. =1,16(1,70+ 0,0557Т)*10-4Вт/(м*К); показатель преломления n435,9 1,1118 при 20,33 К.Ур-ние температурной зависимости давления пара над жидким и твердым водородом: lgO,0075p (Па) = А - В/Т + СТ (значения А, В и С приведены в табл. 4). Твердый водород кристаллизуется в гексагон. решетке (а = = 0,378 нм, с = 0,6167 нм), в узлах к-рой расположены молекулы Н2, связанные между собой слабыми межмол. силами; плотн. 86,67 кг/м3; С° 4,618 Дж/(моль*К) при 13 К; диэлектрик. При давлении свыше 10000 МПа предполагается фазовый переход с образованием структуры, построенной из атомов и обладающей металлич. св-вами. Теоретически предсказана возможность сверхпроводимости "металлич.водорода". Водород в обычном состоянии при низких т-рах мало активен, без нагревания реагирует лишь с F2 и на свету с С12. С неметаллами водород взаимод. активнее, чем с металлами. С кислородом реагирует практически необратимо, образуя воду с выделением 285,75 МДж/моль тепла; в присут. катализаторов (Pt, Pel, Ni) эта р-ция идет достаточно быстро при 80-130 °С. С азотом в присут. катализатора при повышенных т-рах и давлениях водород образует аммиак, с галогенами -галогеноводороды, с халькогенами - гидриды: H2S (выше 600 °С), H2Se (выше 530 °С) и Н2Те (выше 730 °С). С углеродом водород реагирует только при высоких т-рах, образуя углеводороды. Практич. значение имеют р-ции водорода с СО, при к-рых в зависимости от условий и катализатора образуются метанол или (и) др. соединения. Со щелочными и щел.-зем. металлами, элементами III, IV, V и VI гр. периодич. системы, а также с интерметаллич. соед. водород образуетгидриды. Водород восстанавливает оксиды и галогениды мн. металлов до металлов, ненасыщ. углеводероды - до насыщенных (см. Гидрирование). Водородлегко отдает свой электрон, в р-ре отрывается в виде протона от многих соед., обусловливая их кислотные св-ва. В водных р-рах Н+ образует с молекулой водыион гидроксония Н3О . Входя в состав молекул различных соед., водород склонен образовывать со многими электроотрицат. элементами (F, О, N, С, В, Cl, S, Р)водородную связь. Получение. Осн. виды сырья для пром. произ-ва водорода - прир. газ, жидкие и твердые горючие ископаемые, вода. наиб. кол-во водорода получают паровой конверсией прир. газа, включающей след. стадии. 1) Каталитич. конверсию газа с водяным паром: СН4 + Н2О -> СО + ЗН2 - 206 кДж Осуществляется в присут. Ni на А12О3 при 750-870 °С в трубчатых реакторах. Для наружного обогрева стальных трубок реактора часть прир. газа сжигают. По др. способу в смесь газа с водяным паром добавляют О2 (0,55 — 0,65 м3 на 1 м3 СН4), благодаря чему конверсия СН4 становится автотермичной (в результате экзотермич. р-ции: СН4 + 1/2О2-> СО + 2Н2 + 35,6 кДж) и не требует наружного обогрева реактора. Этот процесс осуществляют в реакторах шахтного типа при 830-1000°С. 2) Конверсию СО с водяным паром: СО + ЗН2 + Н2О -> СО2 + 4Н2 + 41 кДж; процесс проводят при 370-440 °С в присут. железохромового кат. (первая ступень) и при 230-260 °С в присут. цинкхроммедного кат. (вторая ступень). 3) Очистку газовой смеси от СО2 и остатков непрореагировавших СО, СН4 и Н2О осуществляют обычными методами (см. Газов очистка). Известен также способ высокотемпературной (1350-1450 °С) конверсии газообразных углеводородов, основанный на их неполном окислении кислородом до СО в своб. объеме без катализатора. Дальнейшие стадии конверсии СО и очистки газовой смеси аналогичны применяемым в первом способе. Получение водорода из твердых горючих ископаемых включает их переработку с водяным паром и воздухом или О2 (газификацию): С + Н2О -> СО + Н2 - 118,9 кДж; 2С + О2 -> 2СО + 230 кДж. В результате образуется водяной газ (содержащий до 40% СО и 50% Н2), а также СО2, СН4, N2 и примеси сернистых соединений. После очистки от последних получают водород, как указано в первом способе. Аналогично перерабатывают и тяжелые нефтяные остатки. Газ, содержащий 85-90% водорода и 10-15% др. газов, гл. обр. углеводородов, получают в кач-ве побочного продукта на нефтеперерабатывающих заводах (см.Газы нефтепереработки). Из газа коксовых печей, содержащего 55-60% водорода, последний выделяют методом фракц. конденсации при глубоком охлаждении (см. Газов разделение). Сравнительно небольшое кол-во водорода (и одновременно О2) получают электролизом воды. Электролитом служит водный р-р КОН (350-400 г/л); давление вэлектролизерах от атмосферного до 4 МПа, их производительность 4-500 м3/ч, расход электроэнергии 5,1-5,6 кВт*ч на 1 м3 водорода (теоретич. расход при 25 °С 2,94 кВт*ч). Разрабатываются высокотемпературные процессы электролита ч. разложения воды (с целью снижения расхода электроэнергии и уменьшения объема аппаратуры). значит. кол-ва водорода образуются в кач-ве побочного продукта при электролитич. произ-ве С12 и щелочей, хлоратов, Н2О2. Перспективные методы получения водорода - термохим. и термоэлектрохим. циклы разложения воды с использованием тепла, выделяемого в атомных реакторах (см. Водородная энергетика). В этих циклах все компоненты системы, кроме воды, полностью регенерируются. Производится также жидкий п-Н2. Для этого водород тщательно очищают от всех примесей, в т. ч. от О2 (до содержания менее 1*10-9 объемных долей), охлаждают жидким N2, сжижают путем дросселирования и расширения газа в детандере и осуществляют орто-пара-превращение водорода в присут.катализаторов. Расход энергии составляет 72-105 МДж на 1 кг жидкого водорода. Мощность установок по произ-ву жидкого водорода в США превышает 155 т/сут. Атомарный водород образуется из молекулярного при термич. диссоциации, под действием электрич. разрядов, излучения с длиной волны менее 85 нм и при воздействии медленных электронов. Определение. В составе газовых смесей водород определяют методами хроматографии, масс-спектрометрии, каталитич. сжиганием с послед. определением кол-ва образовавшейся воды, по уменьшению объема и тепловому эффекту, измерением теплопроводности газовой смеси. Применение. Газообразный водород применяют для синтеза NH3, CH3OH, высших спиртов, углеводородов, НС1 и др., как восстановитель при получении мн. орг. соединений, в т.ч. пищ. жиров. В металлургии водород используют для получения металлов, создания защитной среды при обработке металлов и сплавов, в нефтепереработке - для гидроочистки нефтяных фракций и смазочных масел, гидрирования и гидрокрекинга нефтяных дистиллатов, нефтяных остатков и смол. Водород применяют также в произ-ве изделий из кварцевого стекла и др. с использованием водородно-кислородного пламени (т-ра выше 2000°С), для атомно-водородной сварки тугоплавких сталей и сплавов, для охлаждения турбогенераторов, как восстановитель в топливных элементах. Жидкий водород применяется как горючее в ракетной и космич. технике, для заполнения пузырьковых камер, в кач-ве хладагента в криогенных конденсационных и адсорбционных вакуум-насосах. В 1980 в США расход водорода составил (% к общему потреблению): на синтез NH3 - 26, синтез СН3ОН - 3,3, гидрокрекинг - 34,7, гидроочистку нефтепродуктов - 21, нефтехим. синтез - 3,5. Водород нетоксичен, но пожаро- и взрывоопасен; т-ра взрывного самовоспламенения в воздухе 577 °С; КПВ в воздухе 4-75%, в О2-4,65-96% по объему. Жидкийводород при попадании на открытые участки тела может вызвать сильное обморожение. Газообразный водород хранят в мокрых и сухих газгольдерах, емкостях высокого давления и транспортируют по трубопроводам; малые кол-ва хранят и транспортируют в стальных баллонах под давл. до 20 МПа. Разрабатываются проекты подземного хранения больших кол-в водорода в выработанных месторождениях нефти и газа, горных выработках, искусств. соляных кавернах. Жидкийводород хранят и транспортируют в спец. герметич. резервуарах с эффективной тепловой изоляцией; сосуды емкостью от 15 до 75 л могут иметь экран из жидкого N2. Емкость автомобильных прицепов и полуприцепов 25-75 м3, железнодорожных цистерн 100-125 м3, стационарных хранилищ - до 3000 м3. Ведутся разработки в области техники получения и хранения водорода в твердом и шугообразном (до 50% твердой фазы) состоянии. Водород можно хранить и транспортировать в виде твердых гидридов металлов и интерметаллич. соед., способных поглощать и отдавать при нагр. неск. сотен объемов водорода на единицу своей массы. Мировое произ-во водорода свыше 30 млн. т/год (1980). Водород был открыт в 1-й пол. 16 в. Парацельсом. В 1776 Г. Кавендиш впервые исследовал его св-ва, в 1783-1787 А. Лавуазье показал, что водород входит в состав воды, включил его в список хим. элементов и предложил название "гидроген". СЛОВАРИК: |
АБЛЯЦИОННЫЕ МАТЕРИАЛЫ (от позднелат. ablatio- отнятие, устранение), теплозащитные материалы, действие к-рых основано на абляции-сложном энергоемком процессе уноса в-ва с пов-сти твердого тела потоком горячего газа. Абляционные материалы наносят на пов-сть ракет, космич. аппаратов и камер сгорания ракетных двигателей для обеспечения температурного режима их работы при воздействии интенсивных тепловых потоков.
В общей форме абляция м. б. описана след. уравнением:
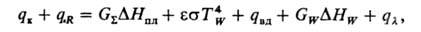
где qк-конвективный тепловой поток к пов-сти материала; qR-радиац. тепловой поток;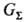 -суммарный унос массы в результате пиролиза пов-сти, выделения газообразных продуктов и стекания расплава;
-суммарный унос массы в результате пиролиза пов-сти, выделения газообразных продуктов и стекания расплава;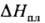 -энтальпия плавления; GW-унос продуктов пиролиза;
-энтальпия плавления; GW-унос продуктов пиролиза;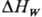 -энтальпия физ.-хим. превращений;
-энтальпия физ.-хим. превращений;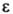 -коэф. черноты;
-коэф. черноты;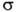 -постоянная Стефана - Больцмана; ГW-абс. т-ра пов-сти; qвл-тепло, отводимое в результате вдува газообразных продуктов пиролиза;
-постоянная Стефана - Больцмана; ГW-абс. т-ра пов-сти; qвл-тепло, отводимое в результате вдува газообразных продуктов пиролиза;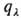 -тепловой поток к защищаемой пов-сти.
-тепловой поток к защищаемой пов-сти.
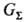 -суммарный унос массы в результате пиролиза пов-сти, выделения газообразных продуктов и стекания расплава;
-суммарный унос массы в результате пиролиза пов-сти, выделения газообразных продуктов и стекания расплава;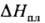 -энтальпия плавления; GW-унос продуктов пиролиза;
-энтальпия плавления; GW-унос продуктов пиролиза;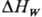 -энтальпия физ.-хим. превращений;
-энтальпия физ.-хим. превращений;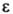 -коэф. черноты;
-коэф. черноты;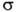 -постоянная Стефана - Больцмана; ГW-абс. т-ра пов-сти; qвл-тепло, отводимое в результате вдува газообразных продуктов пиролиза;
-постоянная Стефана - Больцмана; ГW-абс. т-ра пов-сти; qвл-тепло, отводимое в результате вдува газообразных продуктов пиролиза;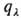 -тепловой поток к защищаемой пов-сти.
-тепловой поток к защищаемой пов-сти.
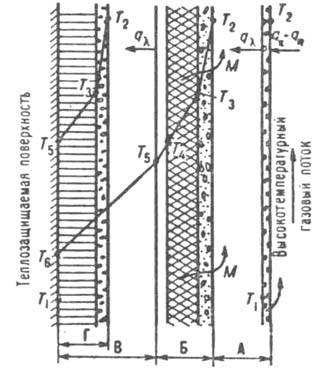
Схема тепло- и массообмена в комбинированном абляционном материале: А-уносимый слой; Б-зона абляции; В-неизменный материал; Г пример возможного достижения зоной Б теплозащищаемой стенки; qk , qR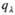 -см. обозначения в тексте; 7\-начальная т-ра; Т2-т-ра кипения; Т3-,т-ра плавления, T4-т-ра начала "коксования"; Г5-т-ра начала термич. разложения; Т6-т-ра теплозащищаемой стенки в момент времени, соответствующий указанному положению зоны Б; М-направление движения уносимой массы
-см. обозначения в тексте; 7\-начальная т-ра; Т2-т-ра кипения; Т3-,т-ра плавления, T4-т-ра начала "коксования"; Г5-т-ра начала термич. разложения; Т6-т-ра теплозащищаемой стенки в момент времени, соответствующий указанному положению зоны Б; М-направление движения уносимой массы
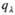 -см. обозначения в тексте; 7\-начальная т-ра; Т2-т-ра кипения; Т3-,т-ра плавления, T4-т-ра начала "коксования"; Г5-т-ра начала термич. разложения; Т6-т-ра теплозащищаемой стенки в момент времени, соответствующий указанному положению зоны Б; М-направление движения уносимой массы
-см. обозначения в тексте; 7\-начальная т-ра; Т2-т-ра кипения; Т3-,т-ра плавления, T4-т-ра начала "коксования"; Г5-т-ра начала термич. разложения; Т6-т-ра теплозащищаемой стенки в момент времени, соответствующий указанному положению зоны Б; М-направление движения уносимой массыРазличают след. виды абляционных материалов: разлагающиеся (политетрафторэтилен, полиэтилен и др.), сублимирующиеся (напр., графит при т-рах ок. 3800 °С, давлениях до 10 МПа и отсутствии окисляющего агента), плавящиеся (кварц, пенокера-мика и др.). Наиб. распространены армированные орг. и кремнийорг. материалы, абляция к-рых характеризуется совокупностью неск. одновременно протекающих процессов, как показано на рисунке. В начальный момент на пов-сти образуется пленка расплава и начинается нагрев нижележащих слоев, возникает зона абляции, т.е. плавления и пиролиза с образованием твердого, обычно пористого углеродного остатка. С течением времени эта зона смещается в сторону защищаемой пов-сти, толщина слоя неизменного абляционного материала уменьшается, а т-ра возрастает. После окончания воздействия высокотемпературного газового потока зона абляции может достигнуть защищаемой пов-сти, что допустимо лишь по истечении расчетного времени работы изделия.
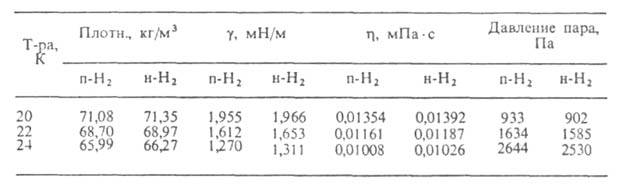
Абляционные материалы могут быть твердыми (на основе термореактивных синтетич. смол и линейных полимеров) и эластичными (на основе нитрильного этилен-пропиленового, синтетич. изо-пренового каучука и др.); армирование материалов волокнистыми наполнителями существенно улучшает их абляционные св-ва (табл. 1 и 2).
Табл. 1.-АБЛЯЦИЯ ПОЛИМЕРОВ В ДОЗВУКОВОМ ГАЗОВОМ ПОТОКЕ(испытания на кислородно-ацетиленовой горелке)
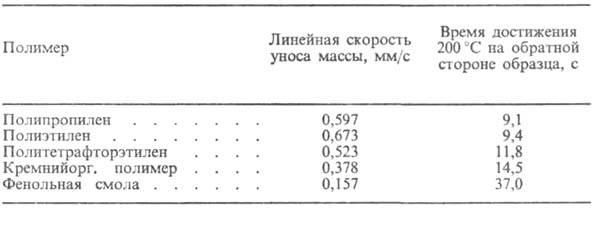

Эластичные абляционные материалы используют гл. обр. для защиты камер сгорания крупногабаритных ракетных двигателей, для внеш. теплозащиты гиперзвуковых самолетов, ракет и космич. аппаратов, входящих в атмосферу Земли или др. планет. Их эластичность, характеризуемая, напр., относит. удлинением при разрыве, может составлять 200% и более. Низкую плотность абляционных материалов (до 0,16 г/см3) обеспечивают введением пенообразователей или полых стеклянных, фенольных или др. микросфер (т. наз. синтактные абляционные материалы).

АБСОРБЦИОННАЯ СПЕКТРОСКОПИЯ, изучает спектры поглощения электромагн. излучения атомами и молекулами в-ва в разл. агрегатных состояниях. Интенсивность светового потока при его прохождении через исследуемую среду уменьшается вследствие превращения энергии излучения в разл. формы внутр. энергии в-ва и (или) в энергию вторичного излучения. Поглощат. способность в-ва зависит гл. обр. от электронного строения атомов и молекул, а также от длины волны и поляризации падающего света, толщины слоя, концентрации в-ва, т-ры, наличия электрич. и магн. полей. Для измерения поглощат. способности используют спектрофотометры-оптич. приборы, состоящие из источника света, камеры для образцов, монохроматора (призма или дифракционная решетка) и детектора. Сигнал от детектора регистрируется в виде непрерывной кривой (спектра поглощения) или в виде таблиц, если спектрофотометр имеет встроенную ЭВМ. Применение абсорбционной спектроскопии основано на след. законах.
1. Закон Бугера-Ламберта: если среда однородна и слой в-ва перпендикулярен падающему параллельному световому потоку, то I = I0 exp (— kd), где I0 и I-интенсивности соотв. падающего и прошедшего через в-во света, d-толщина слоя, k-коэф. поглощения, к-рый не зависит от толщины поглощающего слоя и интенсивности падающего излучения. Для характеристики поглощат. способности широко используют коэф. экстинкции, или светопоглощения; k' = k/2,303 (в см-1) и оптич. плотность А = lg I0/I, а также величину пропускания Т= I/I0. Отклонения от закона известны только для световых потоков чрезвычайно большой интенсивности (для лазерного излучения). Коэф. k зависит от длины волны падающего света, т.к. его величина определяется электронной конфигурацией молекул и атомов и вероятностями переходов между их электронными уровнями. Совокупность переходов создает спектр поглощения (абсорбции), характерный для данного в-ва.
2. Закон Бера: каждая молекула или атом независимо от относит. расположения др. молекул или атомов поглощает одну и ту же долю энергии излучения, т.е.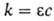 , где с-концентрация в-ва. Если с выражена в моль/л,
, где с-концентрация в-ва. Если с выражена в моль/л,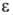 наз. молярным коэф. поглощения. Отклонения от этого закона свидетельствуют об образовании димеров, полимеров, ассоциатов, о хим. взаимодействии поглощающих частиц.
наз. молярным коэф. поглощения. Отклонения от этого закона свидетельствуют об образовании димеров, полимеров, ассоциатов, о хим. взаимодействии поглощающих частиц.
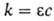 , где с-концентрация в-ва. Если с выражена в моль/л,
, где с-концентрация в-ва. Если с выражена в моль/л,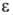 наз. молярным коэф. поглощения. Отклонения от этого закона свидетельствуют об образовании димеров, полимеров, ассоциатов, о хим. взаимодействии поглощающих частиц.
наз. молярным коэф. поглощения. Отклонения от этого закона свидетельствуют об образовании димеров, полимеров, ассоциатов, о хим. взаимодействии поглощающих частиц.3. Объединенный закон Бугера-Ламберта-Бера:
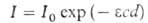
Вид спектра поглощения определяется как природой образующих его атомов и молекул, так и агрегатным состоянием в-ва. Спектр разреженных атомарныхгазов - ряд узких дискретных линий, положение к-рых зависит от энергии основного и возбужденных электронных состояний атомов. Спектры молекулярных газов- полосы, образованные тесно расположенными линиями, соответствующими переходам между колебательным и вращательным энергетич. уровнями молекул. Спектр в-ва в конденсиров. фазе определяется не только природой составляющих его молекул, но и межмол. взаимодействиями, влияющими на структуру электронных уровней. Обычно такой спектр состоит из ряда широких полос разл. интенсивности. Иногда в нем проявляется структура колебат. уровней (особенно у кристаллов при охлаждении). Прозрачные среды, напр. вода, кварц, не имеют в спектре полос поглощения, а обладают лишь границей поглощения.
По спектрам поглощения проводят качеств. и количеств. анализ в-в (см. Фотометрический анализ, Атомно-абсорб-ционный анализ). Абсорбционнаяспектроскопия широко применяют для изучения строения в-ва. Она особенно эффективна при исследовании процессов в жидких средах; по изменениям положения, интенсивности и формы полос поглощения судят об изменениях состава и строения поглощающих свет частиц без их выделения из р-ров.
Для наблюдения за процессами, происходящими в течение короткого промежутка времени (от неск. с до ~ 10-12 с), широко применяют методы кинетич.спектроскопии. Они основаны на регистрации (с помощью фотопластинок или фотоэлектрич. приемников) спектров поглощения или испускания исследуемой системы после кратковременного воздействия на нее, напр. быстрого смешения с реагентами или возбуждения внеш. источником энергии - светом, потокомэлектронов, электрич. полем и т.п. Спектром сравнения служит спектр "невозбужденной" системы. Методы кинетич. спектроскопии используют для изучения механизма р-ций (в частности, для установления состава промежут. продуктов), количеств. определения скоростей р-ций.



Комментариев нет:
Отправить комментарий