Третий элемент литий, что в переводе с греческого каменный. Хотите узнать почему?



 ЛИТИЙ (от греч. lithos - камень; лат. Lithium) Li, хим. элемент I гр. периодич. системы, относится к щелочным металлам, ат. н. 3, ат. м. 6,941. Состоит из двух стабильных изотопов 6Li (7,52%) и 7Li (92,48%), для к-рых поперечное сечение захвата тепловых нейтронов составляет соотв. 9,45.10-26м2 и 3,3.10-30м2 (для прир. смеси изотопов 6,7 - 7,1.10-27 м2). Конфигурация внеш. электронной оболочки 2s1; степень окисления +1; энергия ионизации Li° : Li + 5,39178 эВ;сродство к электрону 0,591 эВ; электроотрицательность по Полингу 0,95; ат. радиус 0,157 нм, ионный радиус Li+ (в скобках приведены координац. числа) 0,073 нм (4), 0,090 нм (6), 0,106 нм (8). Содержание лития в земной коре 6,5.10-3% по массе. Осн. минералы: сподумен LiAl[Si2O6], лепидолит KLi1,5Al1,5[Si3AlO10](F,OH)2 и петалит (Li,Na)[Si4AlO10]. Перспективные источники сырья для произ-ва лития - межзернистая рапа соленосных отложений (41% мировых экзогенных запасов) и подземные воды (до 10 мг/л). Общие запасы Li2O в недрах и водах зарубежных стран, кроме вод Мирового океана, составляют ок. 24 млн. т. наиб. крупные разведанные месторождения пром. руд находятся в СССР, США, Канаде, Чили, Зимбабве, Бразилии и Намибии.
ЛИТИЙ (от греч. lithos - камень; лат. Lithium) Li, хим. элемент I гр. периодич. системы, относится к щелочным металлам, ат. н. 3, ат. м. 6,941. Состоит из двух стабильных изотопов 6Li (7,52%) и 7Li (92,48%), для к-рых поперечное сечение захвата тепловых нейтронов составляет соотв. 9,45.10-26м2 и 3,3.10-30м2 (для прир. смеси изотопов 6,7 - 7,1.10-27 м2). Конфигурация внеш. электронной оболочки 2s1; степень окисления +1; энергия ионизации Li° : Li + 5,39178 эВ;сродство к электрону 0,591 эВ; электроотрицательность по Полингу 0,95; ат. радиус 0,157 нм, ионный радиус Li+ (в скобках приведены координац. числа) 0,073 нм (4), 0,090 нм (6), 0,106 нм (8). Содержание лития в земной коре 6,5.10-3% по массе. Осн. минералы: сподумен LiAl[Si2O6], лепидолит KLi1,5Al1,5[Si3AlO10](F,OH)2 и петалит (Li,Na)[Si4AlO10]. Перспективные источники сырья для произ-ва лития - межзернистая рапа соленосных отложений (41% мировых экзогенных запасов) и подземные воды (до 10 мг/л). Общие запасы Li2O в недрах и водах зарубежных стран, кроме вод Мирового океана, составляют ок. 24 млн. т. наиб. крупные разведанные месторождения пром. руд находятся в СССР, США, Канаде, Чили, Зимбабве, Бразилии и Намибии.
Свойства. Литий - серебристо-белый металл. Выше — 193°С существует модификация с кубич. объемноцентрир. решеткой, а = 0.350 нм, z = 2, пространств. группа Im3m, плотн. 0,533 г/см , ниже — 193°С она переходит в гексагoн. плотноупакованную форму, а = 0,308 нм, с = 0,482 нм, z = 2, пространств. группа Р63/ттс. Т. пл. 180,54 °С, т. кип. 1340°С; С0p 24,86 Дж/(моль.K); DH0пл 3,0 кДж/моль, DH0возг 159,3 кДж/моль (298,15 К); S0298 29,12 Дж/(моль.К); теплопроводность246,0 Вт/(м.К) при 0 °С и 172,2 Вт/(м.К) при 427 °С; r 8,12 мкОм.см при 0°С и 25,55 мкОм.см при 227 °С; парамагнетик, магнитная восприимчивость +1,42.10-5;g 0,3983 Н/м при 181 °С и 0,3778 Н/м при 327 °С; h 5,307.10-4 Па.с при 227°С и 3,584.10-4 Па.с при 427 oС температурный коэф. линейного расширения 5,6.10 К-1, объемного расширения 9,2.10-8 К-1 (273-451 К).Литий - мягкий и пластичный металл, может обрабатываться прессованием и прокаткой; твердость по Бринеллю 7850 Па, модуль упругости 4,9 ГПа, sраст 1,16 МПа. Мн. хим. р-ции лития протекают менее энергично, чем у др. щелочных металлов. С совершенно сухим воздухом он практически не реагирует при комнатной т-ре и окисляется в нем только при нагревании. Во влажном воздухе образует преим. Li3N, привлажности воздуха более 80% - LiOH и Li2CO3. С сухим О2 при комнатной т-ре не реагирует, при нагр. горит голубым пламенем с образованием Li2O; для чистого лития т. всп. 640 °С. С водой реагирует, давая LiOH и выделяя Н2 без плавления и вспышки; расплав лития при контакте с водой взрывает. Литий непосредственно соединяется с F2, Сl2 и Вr2, а при нагр. и с I2. С разб. к-тами взаимод. бурно, давая соли и выделяя Н2. В жидком NH3 раств., образуя синий р-р с металлич. проводимостью. В этом р-ре литий медленно реагирует с NH3 (катализатором служит влага) с выделением Н2 и образованием LiNH2. С Н2 при 500 °С дает лития гидрид LiH, при небольшом нагревании в токе сухого N2-нитрид Li3N, с расплавленной S - сульфид Li2S, при нагр. в токе С2Н2 или С2Н4 - карбидLi2C2. Литий легко сплавляется почти со всеми металлами и хорошо раств. в ртути. С Mg, Zn и Аl образует твердые р-ры, с Ag, Hg, Mg, Zn, Tl, Al, Pb, Bi и др. -интерметаллиды (напр., LiAg, LiHg, LiMg2, Li2Zn3). Важнейшим соед. лития посвящены отдельные статьи (см., напр., Литийорганические соединения, Лития гидроксид, Лития карбонат, Лития оксид, Лития фторид). Ниже приводятся сведения о др. важных соед. лития. Амид LiNH2 - 6ecцв. кристаллы, с тетрагон. решеткой; т. пл. 430 °С; плотн. 1,178 г/см3 (17,5°С); с водой образует LiOH и NH3, с к-тами - соли лития и аммония; во влажном воздухе медленно гидролизуется, при нагр. до 450 °С переходит в Li2NH с выделением NH3. Применяется как катализатор. Нитрид Li3N - зеленовато-черные кристаллы с гексагон. решеткой (а = 0,366 нм, с = 0,388 нм, z = 1, пространств. группа P/6mmm); т. пл. 813°С; плотн. 1,38 г/см3; С0p 75,2 Дж/(моль.К); DH0обр -164,0 кДж/моль; S029862,6 Дж/(моль.К); энергично взаимод. с водой с образованием LiOH и NH3; при нагр. в среде Н2 переходит в LiH с выделением NH3. Сульфид Li2S - зеленовато-желтые кристаллы с кубич. решеткой (а = 0,571 нм, z = 4, пространств. группа Fm3m); т. пл. 1370°С; плотн. 1,63 г/см3; DH0обр -447,3 кДж/моль; S0298 62,8 Дж/(моль.К); О2, Н2О2, КСlO3, РbО2 и др. окисляют Li2S при 300 °С до Li2SO4; с Н2 не взаимод. даже при высокой т-ре; водой легко гидролизуется.
Получение. Минералы лития в зависимости от состава разлагают H2SO4 (кислотный способ) или спеканием с СаО и СаСО3 (щелочной способ), K2SO4(солевой способ), СаСО3 и СаСl2 (щелочно-солевой способ). По первому методу получают р-р Li2SO4, к-рый освобождают от примесей обработкой Са(ОН)2 и Na2CO3. При выщелачивании спека водой при щелочном методе в р-р переходит LiOH, при солевом - Li2SO4, при щелочно-солевом - LiCl. Все эти методы, кроме щелочного, предусматривают получение готового продукта в виде Li2CO3, используемого непосредственно и служащего источником для синтеза др. соединений лития. Металлич. литий получают электролизом расплавл. смеси LiCl и КСl (или ВаСl2) с послед. очисткой от примесей вакуумной дистилляцией,ректификацией или зонной плавкой. Его также получают вакуум-термич. восстановлением LiAlO2 алюминием при 13-66 Па и 1150-1200°С, Li2O -кремнием илиалюминием в присут. СаО при 950-1000 °С и 0,1 Па, сподумена - ферросилицием в присут. СаСО3 при 1050-1150 °С и 1,3-4,0 Па.
Определение. Качественно литий обнаруживают по карминово-красному окрашиванию пламени горелки летучими соед. лития и по наиб. четко выраженным спектральным линиям лития: 670,78 и 610,36 нм. Количественно литий определяют пламенно-фотометрич. (при содержании лития в пробе 0,1-10%), спектрографич. и гравиметрич. методами. В последнем случае литий отделяют от др. щелочных металлов в виде LiCl экстракцией безводным ацетоном, после отделения LiCl переводят в Li2SO4, к-рый прокаливают и взвешивают. Литий определяют также фотометрически с помощью хиназолиназо (при содержании лития в пробе 4.10-4 — 6.10-2%), флуориметрически - с помощью 5,7-дибром-8-гидроксихинолина (предел обнаружения 0,1 мкг/мл лития).
Применение. Литий используют: в произ-ве анодов для хим. источников тока на основе неводных и твердых электролитов; как компонент сплавов с Mg и Аl, антифрикц. сплавов (баббитов), сплавов с Si для изготовления холодных катодов в электровакуумных приборах; для раскисления, дегазации, модифицирования и рафинирования Сu, медных, цинковых и никелевых сплавов с целью улучшения их структуры и повышения электрич. проводимости; как катализатор полимеризации (напр., изопрена), ацетилирования и др. Жидкий литий - теплоноситель в ядерных реакторах. Изотоп 6Li используют для получения трития.Мелкие крошки лития вызывают хим. ожоги влажной кожи и глаз. Загоревшийся литий засыпают NaCl или содой. Хранят литий в герметически закрытых жестяных коробках под слоем пастообразной массы из парафина и минер. масла или в тонкостенных алюминиевых или медных оболочках; допускается хранение под слоем газолина или петролейного эфира. Отходы утилизируют обработкой этанолом с послед. разложением образовавшегося этилата водой.Литий открыл А. Арфведсон в 1817, металлич. литий получил впервые Г. Дэви в 1818.
Словарик:
Свойства. Литий - серебристо-белый металл. Выше — 193°С существует модификация с кубич. объемноцентрир. решеткой, а = 0.350 нм, z = 2, пространств. группа Im3m, плотн. 0,533 г/см , ниже — 193°С она переходит в гексагoн. плотноупакованную форму, а = 0,308 нм, с = 0,482 нм, z = 2, пространств. группа Р63/ттс. Т. пл. 180,54 °С, т. кип. 1340°С; С0p 24,86 Дж/(моль.K); DH0пл 3,0 кДж/моль, DH0возг 159,3 кДж/моль (298,15 К); S0298 29,12 Дж/(моль.К); теплопроводность246,0 Вт/(м.К) при 0 °С и 172,2 Вт/(м.К) при 427 °С; r 8,12 мкОм.см при 0°С и 25,55 мкОм.см при 227 °С; парамагнетик, магнитная восприимчивость +1,42.10-5;g 0,3983 Н/м при 181 °С и 0,3778 Н/м при 327 °С; h 5,307.10-4 Па.с при 227°С и 3,584.10-4 Па.с при 427 oС температурный коэф. линейного расширения 5,6.10 К-1, объемного расширения 9,2.10-8 К-1 (273-451 К).Литий - мягкий и пластичный металл, может обрабатываться прессованием и прокаткой; твердость по Бринеллю 7850 Па, модуль упругости 4,9 ГПа, sраст 1,16 МПа. Мн. хим. р-ции лития протекают менее энергично, чем у др. щелочных металлов. С совершенно сухим воздухом он практически не реагирует при комнатной т-ре и окисляется в нем только при нагревании. Во влажном воздухе образует преим. Li3N, привлажности воздуха более 80% - LiOH и Li2CO3. С сухим О2 при комнатной т-ре не реагирует, при нагр. горит голубым пламенем с образованием Li2O; для чистого лития т. всп. 640 °С. С водой реагирует, давая LiOH и выделяя Н2 без плавления и вспышки; расплав лития при контакте с водой взрывает. Литий непосредственно соединяется с F2, Сl2 и Вr2, а при нагр. и с I2. С разб. к-тами взаимод. бурно, давая соли и выделяя Н2. В жидком NH3 раств., образуя синий р-р с металлич. проводимостью. В этом р-ре литий медленно реагирует с NH3 (катализатором служит влага) с выделением Н2 и образованием LiNH2. С Н2 при 500 °С дает лития гидрид LiH, при небольшом нагревании в токе сухого N2-нитрид Li3N, с расплавленной S - сульфид Li2S, при нагр. в токе С2Н2 или С2Н4 - карбидLi2C2. Литий легко сплавляется почти со всеми металлами и хорошо раств. в ртути. С Mg, Zn и Аl образует твердые р-ры, с Ag, Hg, Mg, Zn, Tl, Al, Pb, Bi и др. -интерметаллиды (напр., LiAg, LiHg, LiMg2, Li2Zn3). Важнейшим соед. лития посвящены отдельные статьи (см., напр., Литийорганические соединения, Лития гидроксид, Лития карбонат, Лития оксид, Лития фторид). Ниже приводятся сведения о др. важных соед. лития. Амид LiNH2 - 6ecцв. кристаллы, с тетрагон. решеткой; т. пл. 430 °С; плотн. 1,178 г/см3 (17,5°С); с водой образует LiOH и NH3, с к-тами - соли лития и аммония; во влажном воздухе медленно гидролизуется, при нагр. до 450 °С переходит в Li2NH с выделением NH3. Применяется как катализатор. Нитрид Li3N - зеленовато-черные кристаллы с гексагон. решеткой (а = 0,366 нм, с = 0,388 нм, z = 1, пространств. группа P/6mmm); т. пл. 813°С; плотн. 1,38 г/см3; С0p 75,2 Дж/(моль.К); DH0обр -164,0 кДж/моль; S029862,6 Дж/(моль.К); энергично взаимод. с водой с образованием LiOH и NH3; при нагр. в среде Н2 переходит в LiH с выделением NH3. Сульфид Li2S - зеленовато-желтые кристаллы с кубич. решеткой (а = 0,571 нм, z = 4, пространств. группа Fm3m); т. пл. 1370°С; плотн. 1,63 г/см3; DH0обр -447,3 кДж/моль; S0298 62,8 Дж/(моль.К); О2, Н2О2, КСlO3, РbО2 и др. окисляют Li2S при 300 °С до Li2SO4; с Н2 не взаимод. даже при высокой т-ре; водой легко гидролизуется.
Получение. Минералы лития в зависимости от состава разлагают H2SO4 (кислотный способ) или спеканием с СаО и СаСО3 (щелочной способ), K2SO4(солевой способ), СаСО3 и СаСl2 (щелочно-солевой способ). По первому методу получают р-р Li2SO4, к-рый освобождают от примесей обработкой Са(ОН)2 и Na2CO3. При выщелачивании спека водой при щелочном методе в р-р переходит LiOH, при солевом - Li2SO4, при щелочно-солевом - LiCl. Все эти методы, кроме щелочного, предусматривают получение готового продукта в виде Li2CO3, используемого непосредственно и служащего источником для синтеза др. соединений лития. Металлич. литий получают электролизом расплавл. смеси LiCl и КСl (или ВаСl2) с послед. очисткой от примесей вакуумной дистилляцией,ректификацией или зонной плавкой. Его также получают вакуум-термич. восстановлением LiAlO2 алюминием при 13-66 Па и 1150-1200°С, Li2O -кремнием илиалюминием в присут. СаО при 950-1000 °С и 0,1 Па, сподумена - ферросилицием в присут. СаСО3 при 1050-1150 °С и 1,3-4,0 Па.
Определение. Качественно литий обнаруживают по карминово-красному окрашиванию пламени горелки летучими соед. лития и по наиб. четко выраженным спектральным линиям лития: 670,78 и 610,36 нм. Количественно литий определяют пламенно-фотометрич. (при содержании лития в пробе 0,1-10%), спектрографич. и гравиметрич. методами. В последнем случае литий отделяют от др. щелочных металлов в виде LiCl экстракцией безводным ацетоном, после отделения LiCl переводят в Li2SO4, к-рый прокаливают и взвешивают. Литий определяют также фотометрически с помощью хиназолиназо (при содержании лития в пробе 4.10-4 — 6.10-2%), флуориметрически - с помощью 5,7-дибром-8-гидроксихинолина (предел обнаружения 0,1 мкг/мл лития).
Применение. Литий используют: в произ-ве анодов для хим. источников тока на основе неводных и твердых электролитов; как компонент сплавов с Mg и Аl, антифрикц. сплавов (баббитов), сплавов с Si для изготовления холодных катодов в электровакуумных приборах; для раскисления, дегазации, модифицирования и рафинирования Сu, медных, цинковых и никелевых сплавов с целью улучшения их структуры и повышения электрич. проводимости; как катализатор полимеризации (напр., изопрена), ацетилирования и др. Жидкий литий - теплоноситель в ядерных реакторах. Изотоп 6Li используют для получения трития.Мелкие крошки лития вызывают хим. ожоги влажной кожи и глаз. Загоревшийся литий засыпают NaCl или содой. Хранят литий в герметически закрытых жестяных коробках под слоем пастообразной массы из парафина и минер. масла или в тонкостенных алюминиевых или медных оболочках; допускается хранение под слоем газолина или петролейного эфира. Отходы утилизируют обработкой этанолом с послед. разложением образовавшегося этилата водой.Литий открыл А. Арфведсон в 1817, металлич. литий получил впервые Г. Дэви в 1818.
Словарик:
АВИАКЕРОСИНЫ, смеси парафиновых (20-60%), нафтеновых (20-60%), ароматич. (18,5-22,0%) и непредельных (0,3-1,0%) углеводородов, используемые кактопливо для самолетов и вертолетов с газотурбинными двигателями. Авиакеросин получают в осн. при прямой перегонке нефти (часто с послед. гидроочисткойили гидрированием). В кач-ве авиакеросина обычно применяют дистилляты, содержащие лигроиновые, керосиновые или газойлевые фракции, ограниченно - смеси широкого фракционного состава (пределы выкипания 60-230 °С), включающие бензиновые дистилляты.
ХАРАКТЕРИСТИКИ АВИАКЕРОСИНОВ, ВЫПУСКАЕМЫХ В СССР
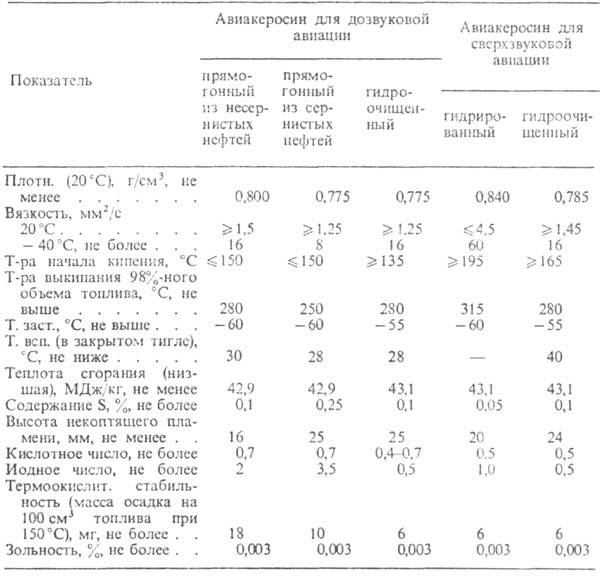

Осн. характеристики авиакеросинов приведены в таблице. Авиакеросины должны вызывать миним. коррозию деталей и узлов двигателей из стали, бронзы имеди. Их коррозионная активность при сгорании обусловлена наличием примесей V, Со, Мо, содержание к-рых не должно превышать 10-5% по массе. Авиакерасины не должны также содержать мех. примеси и воду. Уд. электрич. проводимость авиакеросинов должна составлять не менее 0,6 кСм/м с целью предотвращения накапливания статич. электричества, а КПВ-1,1-7,5%. Для улучшения эксплуатац. свойств нек-рых авиакеросинов в них добавляютантиоксиданты, антистатики, антиобледенительные, антикоррозионные, противоизносные, биоцидные и др. присадки.
АВИРОЛЬ, техн. продукт, содержащий не менее 60% по массе бутилоктадеканоато-9-сульфата аммония CH3(CH2)8CH(OS03NH4)(CH2)7COOC4H9 и не более 25% воды. Маслянистая прозрачная коричневая жидкость; плотн. ок. 1 г/см3 (20°С); легко разбавляется водой, давая устойчивые эмульсии; хорошо раств. в эфире, этаноле, бензоле, ССl4, дихлорэтане, метиленхлориде. Анионное ПАВ; критич. концентрация мицеллообразования (ККМ) 0,9% по массе, поверхностное натяжение при ККМ 32 мН/м, рН 7,2-7,5 (1%-ная водная эмульсия). Получают этерификацией олеиновой к-ты бутанолом с послед. сульфатированием бутилолеата серной к-той и нейтрализацией сульфоэфира аммиачной водой. Применяют в произ-ве хим. волокон как эмульгатор минер. масел в составе авиважных и замасливающих препаратов (придает волокну мягкий гриф и блеск).
За рубежом под названием "авироль" известна группа анионных ПАВ - гл. обр. Na- и NH4-соли алкилсульфатов, алкилэфиросульфатов и сульфированных растит. масел. Л. А. Шиц.
АВОГАДРО ЗАКОН: в равных объемах идеальных газов при одинаковых давлении и т-ре содержится одинаковое число молекул. Согласно Авогадро закону, 1моль любого идеального газа при нормальных условиях (1,01 * 105 Па, 0°С) занимает одинаковый объем (22,41383 ± 0,00070) -10-3 м3. Число молекул в 1 моленаз. Авогадро постоянной. Закон открыт в 1811 А. Авогадро.
Комментариев нет:
Отправить комментарий